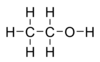
Etanol
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| Etanol |
| | |
| | |
| |
Etil alkohol; hidroksietana; alkohol; etil hidrat; alkohol absolut |
| Identifikasi |
| Nomor CAS | [64-17-5] |
| PubChem | 702 |
| Nomor RTECS | KQ6300000 |
| SMILES | CCO |
| InChI | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
| Sifat |
| Rumus molekul | C2H5OH |
| Massa molar | 46,07 g/mol |
| Penampilan | cairan tak berwarna |
| Densitas | 0,789 g/cm3 |
| Titik leleh | −114,3
|
| Titik didih | 78,4
|
| Kelarutan dalam air | tercampur penuh |
| Keasaman (pKa) | 15,9 |
| Viskositas | 1,200 cP (20 °C) |
| Momen dipol | 1,69 D (gas) |
| Bahaya |
| Klasifikasi EU | Mudah terbakar (F) |
| NFPA 704 | |
| Frasa-R | R11 |
| Frasa-S | S2 S7 S16 |
| Titik nyala | 13 °C (55.4 °F) |
| Senyawa terkait |
| Senyawa terkait | metanol, propanol |
Kecuali dinyatakan sebaliknya, data di atas berlaku
pada temperatur dan tekanan standar (25°C, 100 kPa) Sangkalan dan referensi
|
Etanol, disebut juga
etil alkohol,
alkohol murni,
alkohol absolut, atau
alkohol saja, adalah sejenis cairan yang mudah menguap, mudah terbakar, tak berwarna, dan merupakan alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa ini merupakan
obat psikoaktif dan dapat ditemukan pada
minuman beralkohol dan
termometer modern. Etanol adalah salah satu obat rekreasi yang paling tua.
Etanol termasuk ke dalam alkohol rantai tunggal, dengan
rumus kimia C
2H
5OH dan
rumus empiris C2H6O. Ia merupakan
isomer konstitusional dari
dimetil eter. Etanol sering disingkat menjadi
EtOH, dengan "Et" merupakan singkatan dari gugus etil (C
2H
5).
Fermentasi gula menjadi etanol merupakan salah satu
reaksi organik paling awal yang pernah dilakukan manusia. Efek dari konsumsi etanol yang memabukkan juga telah diketahui sejak dulu. Pada zaman modern, etanol yang ditujukan untuk kegunaan industri dihasilkan dari produk sampingan pengilangan minyak bumi.
[1]
Etanol banyak digunakan sebagai pelarut berbagai bahan-bahan kimia yang ditujukan untuk konsumsi dan kegunaan manusia. Contohnya adalah pada parfum, perasa, pewarna makanan, dan obat-obatan. Dalam kimia, etanol adalah pelarut yang penting sekaligus sebagai stok umpan untuk sintesis senyawa kimia lainnya. Dalam sejarahnya etanol telah lama digunakan sebagai bahan bakar.
Sejarah

Etanol sering digunakan sebagai bahan bakar
Etanol telah digunakan manusia sejak zaman prasejarah sebagai bahan pemabuk dalam
minuman beralkohol. Residu yang ditemukan pada peninggalan
keramik yang berumur 9000 tahun dari
Cina bagian utara menunjukkan bahwa minuman beralkohol telah digunakan oleh manusia
prasejarah dari masa
Neolitik.
[2]
Etanol dan alkohol membentuk larutan
azeotrop. Karena itu pemurnian etanol yang mengandung air dengan cara penyulingan biasa hanya mampu menghasilkan etanol dengan kemurnian 96%. Etanol murni (absolut) dihasilkan pertama kali pada tahun
1796 oleh
Johan Tobias Lowitz yaitu dengan cara menyaring alkohol hasil distilasi melalui
arang.
Lavoisier menggambarkan bahwa etanol adalah senyawa yang terbentuk dari
karbon,
hidrogen dan
oksigen. Pada tahun 1808
Saussure berhasil menentukan rumus kimia etanol. Lima puluh tahun kemudian (1858),
Couper mempublikasikan rumus kimia etanol. Dengan demikian etanol adalah salah satu senyawa kimia yang pertama kali ditemukan rumus kimianya.
[3]
Etanol pertama kali dibuat secara sintetik pada tahun 1826 secara terpisah oleh Henry Hennel dari Britania Raya dan S.G. Sérullas dari Perancis. Pada tahun 1828,
Michael Faraday berhasil membuat etanol dari hidrasi
etilena yang dikatalisis oleh asam. Proses ini mirip dengan proses sintesis etanol industri modern.
[4]
Etanol telah digunakan sebagai bahan bakar lampu di Amerika Serikat sejak tahun 1840, namun pajak yang dikenakan pada alkohol industri semasa
Perang Saudara Amerika membuat penggunaannya tidak ekonomis. Pajak ini dihapuskan pada tahun 1906,
[5] dan sejak tahun 1908 otomobil
Ford Model T telah dapat dijalankan menggunakan etanol.
[6] Namun, dengan adanya pelarangan minuman beralkohol pada tahun 1920, para penjual bahan bakar etanol dituduh berkomplot dengan penghasil minuman alkohol ilegal, dan bahan bakar etanol kemudian ditinggalkan penggunaannya sampai dengan akhir abad ke-20.
[sunting] Sifat-sifat fisika

Volume berlebih campuran etanol dengan air (kontraksi volume)

Kalor pencampuran campuran etanol dengan air

Kesetimbangan uap-cair campuran etanol dengan air (termasuk pula
azeotrop)

Celah ketercampuran (
miscibility gap) pada campuran dodekana dan etanol
Etanol adalah cairan tak berwarna yang mudah menguap dengan aroma yang khas. Ia terbakar tanpa asap dengan lidah api berwarna biru yang kadang-kadang tidak dapat terlihat pada cahaya biasa.
Sifat-sifat fisika etanol utamanya dipengaruhi oleh keberadaan gugus
hidroksil dan pendeknya rantai karbon etanol. Gugus
hidroksil dapat berpartisipasi ke dalam ikatan hidrogen, sehingga membuatnya cair dan lebih sulit menguap dari pada senyawa organik lainnya dengan massa molekul yang sama.
Etanol adalah pelarut yang serbaguna, larut dalam air dan pelarut organik lainnya, meliputi
asam asetat,
aseton,
benzena,
karbon tetraklorida,
kloroform,
dietil eter,
etilena glikol,
gliserol,
nitrometana,
piridina, dan
toluena.
[7][8] Ia juga larut dalam hidrokarbon alifatik yang ringan, seperti
pentana dan
heksana, dan juga larut dalam senyawa klorida alifatik seperti
trikloroetana dan
tetrakloroetilena.
[8]
Campuran etanol-air memiliki volume yang lebih kecil daripada jumlah kedua cairan tersebut secara terpisah. Campuran etanal dan air dengan volume yang sama akan menghasilkan campuran yang volumenya hanya 1,92 kali jumlah volume awal.
[7][9] Pencampuran etanol dan air bersifat
eksotermik dengan energi sekitar 777 J/mol dibebaskan pada 298 K
[10].
Campuran etanol dan air akan membentuk
azeotrop dengan perbandingkan kira-kira 89 mol% etanol dan 11 mol% air
[11]. Perbandingan ini juga dapat dinyatakan sebagai 96% volume etanol dan 4% volume air pada tekanan normal dan T = 351 K. Komposisi azeotropik ini sangat tergantung pada suhu dan tekanan. Ia akan menghilang pada temperatur di bawah 303 K
[12].

Ikatan hidrogen pada etanol padat pada −186 °C
Ikatan hidrogen menyebabkan etanol murni sangat
higroskopis, sedemikiannya ia akan menyerap air dari udara. Sifat gugus hidroksil yang polar menyebabkannya dapat larut dalam banyak senyawa ion, utamanya
natrium hidroksida,
kalium hidroksida,
magnesium klorida,
kalsium klorida,
amonium klorida,
amonium bromida, dan
natrium bromida.
[8] Natrium klorida dan
kalium klorida sedikit larut dalam etanol.
[8] Oleh karena etanol juga memiliki rantai karbon nonpolar, ia juga larut dalam senyawa nonpolar, meliput kebanyakan
minyak atsiri[13] dan banyak perasa, pewarna, dan obat.
Penambahan beberapa persen etanol dalam air akan menurunkan
tegangan permukaan air secara drastis. Campuran etanol dengan air yang lebih dari 50% etanol bersifat mudah terbakar dan mudah menyala. Campuran yang kurang dari 50% etanol juga dapat menyala apabila larutan tersebut dipanaskan terlebih dahulu.
Indeks refraksi etanol adalah 1,36242 (pada
λ=589,3 nm dan 18,35 °C).
[7]
Sifat-sifat kimia
-
 Untuk detail lebih lanjut tentang topik ini, lihat Alkohol.
Untuk detail lebih lanjut tentang topik ini, lihat Alkohol.
Etanol termasuk dalam alkohol primer, yang berarti bahwa karbon yang berikatan dengan gugus hidroksil paling tidak memiliki dua hidrogen atom yang terikat dengannya juga. Reaksi kimia yang dijalankan oleh etanol kebanyakan berkutat pada gugus
hidroksilnya.
Reaksi asam-basa
Gugus hidroksil etanol membuat molekul ini sedikit basa. Ia hampir netral dalam air, dengan
pH 100% etanol adalah 7,33, berbanding dengan pH air murni yang sebesar 7,00. Etanol dapat diubah menjadi
konjugat basanya, ion
etoksida (CH
3CH
2O
−), dengan mereaksikannya dengan
logam alkali seperti
natrium:
[14]
- 2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
ataupun dengan basa kuat seperti natrium hidrida:
- CH3CH2OH + NaH → CH3CH2ONa + H2.
Reaksi seperti ini tidak dapat dilakukan dalam larutan akuatik, karena air lebih asam daripada etanol, sehingga pembentukan hidroksida lebih difavoritkan daripada pembentuk etoksida.
Halogenasi
Etanol bereaksi dengan
hidrogen halida dan menghasilkan
etil halida seperti
etil klorida dan
etil bromida:
- CH3CH2OH + HCl → CH3CH2Cl + H2O
Reaksi dengan HCl memerlukan katalis seperti
seng klorida.
[15] Hidrogen klorida dengan keberadaan seng klorida dikenal sebagai
reagen Lucas.
[14][15]
- CH3CH2OH + HBr → CH3CH2Br + H2O
Reaksi dengan HBr memerlukan proses
refluks dengan katalis
asam sulfat.
[15]
Etil halida juga dapat dihasilkan dengan mereaksikan alkohol dengan
agen halogenasi yang khusus, seperti
tionil klorida untuk pembuatan etil klorida, ataupun
fosforus tribromida untuk pembuatan etil bromida.
[14][15]
- CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
Pembentukan ester
Dengan kondisi di bawah katalis asam, etanol bereaksi dengan
asam karboksilat dan menghasilkan senyawa etil
eter dan air:
- RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O.
Agar reaksi ini menghasilkan rendemen yang cukup tinggi, air perlu dipisahkan dari campuran reaksi seketika ia terbentuk.
Etanol juga dapat membentuk senyawa ester dengan asam anorganik.
Dietil sulfat dan
trietil fosfat dihasilkan dengan mereaksikan etanol dengan
asam sulfat dan
asam fosfat. Senyawa yang dihasilkan oleh reaksi ini sangat berguna sebagai agen etilasi dalam
sintesis organik.
Dehidrasi
Asam kuat yang sangat higroskopis seperti asam sulfat akan menyebabkan dehidrasi etanol dan menghasilkan
etilena maupun
dietil eter:
- 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O (pada 120'C)
- CH3CH2OH → H2C=CH2 + H2O (pada 180'C)
Oksidasi
Etanol dapat dioksidasi menjadi
asetaldehida, yang kemudian dapat dioksidasi lebih lanjut menjadi
asam asetat. Dalam tubuh manusia, reaksi oksidasi ini dikatalisis oleh
enzim tubuh. Pada laboratorium, larutan akuatik oksidator seperti
asam kromat ataupun
kalium permanganat digunakan untuk mengoksidasi etanol menjadi asam asetat. Proses ini akan sangat sulit menghasilkan asetaldehida oleh karena terjadinya overoksidasi. Etanol dapat dioksidasi menjadi asetaldehida tanpa oksidasi lebih lanjut menjadi asam asetat menggunakan
piridinium kloro kromat (
Pyridinium chloro chromate, PCC).
[15]
- C2H5OH + 2[O] → CH3COOH + H2O
Produk oksidasi etanol, asam asetat, digunakan sebagai nutrien oleh tubuh manusia sebagai
asetil-koA.
Pembakaran
Pembakaran etanol akan menghasilkan
karbon dioksida dan
air:
- C2H5OH(g) + 3 O2(g) → 2 CO2(g) + 3 H2O(l);(ΔHr = −1409 kJ/mol[16])Pembuatan
Pembuatan

94% etanol terdenaturasi dalam sebuah botol untuk kegunaan rumah tangga
Etanol dapat diproduksi secara
petrokimia melalui hidrasi
etilena ataupun secara
biologis melalaui
fermentasi gula dengan
ragi.
[17]
Hidrasi etilena
Etanol yang digunakan untuk kebutuhan industri sering kali dibuat dari senyawa
petrokimia, utamanya adalah melalui hidrasi
etilena:
- C2H4(g) + H2O(g) → CH3CH2OH(l).
Katalisa yang digunakan umumnya adalah
asam fosfat[18]. Katalis ini digunakan pertama kali untuk produksi skala besar etanol oleh
Shell Oil Company pada tahun 1947.
[19] Reaksi ini dijalankan dengan tekanan uap berlebih pada suhu 300 °C.
Proses lama yang pernah digunakan pada tahun 1930 oleh Union Carbide
[20] adalah dengan menghidrasi etilena secara tidak langsung dengan mereaksikannya dengan
asam sulfat pekat untuk mendapatkan
etil sulfat. Etil sulfat kemudian di
hidrolisis dan menghasilkan etanol:
[15]
- C2H4 + H2SO4 → CH3CH2SO4H
- CH3CH2SO4H + H2O → CH3CH2OH + H2SO4
Fermentasi
Etanol untuk kegunaan konsumsi manusia (seperti
minuman beralkohol) dan kegunaan bahan bakar diproduksi dengan cara fermentasi. Spesies
ragi tertentu (misalnya
Saccharomyces cerevisiae) mencerna
gula dan menghasilkan etanol dan
karbon dioksida:
- C6H12O6 → 2 CH3CH2OH + 2 CO2.
Proses membiakkan ragi untuk mendapatkan alkohol disebut sebagai
fermentasi. Konsentrasi etanol yang tinggi akan beracun bagi ragi. Pada jenis ragi yang paling toleran terhadap etanol, ragi tersebut hanya dapat bertahan pada lingkungan 15% etanol berdasarkan volume.
[21]
Untuk menghasilkan etanol dari bahan-bahan pati, misalnya
serealia,
pati tersebut harulah diubah terlebih dahulu menjadi gula. Dalam pembuatan
bir, ini dapat dilakukan dengan merendam biji gandum dalam air dan membiarkannya berkecambah. Biji gandum yang beru berkecambah tersebut akan menghasilkan enzim
amilase. Biji kecambah gandum ditumbuk, dan amilase yang ada akan mengubah pati menjadi gula.
Untuk etanol bahan bakar, hidrolisis pati menjadi glukosa dapat dilakukan dengan lebih cepat menggunakan asam sulfat encer, menambahkan fungi penghasil amilase, atapun kombinasi dua cara tersebut.
[22]
Penggunaan
- Pelarut
- Campuran minuman (intoxicant)
- Sintesis bahan kimia lain
Referensi
- ^ Myers, Richard L.; Myers, Rusty L. (2007). The 100 most important chemical compounds: a reference guide. Westport, Conn.: Greenwood Press. hlm. 122. ISBN 0313337586.
- ^ Roach, J. (18 Juli 2005) "9,000-Year-Old Beer Re-Created From Chinese Recipe." National Geographic News., diakses 14 November 2005.
- ^ Couper, A.S. (1858). "On a new chemical theory." Philosophical magazine 16, 104–116. Online reprint
- ^ Hennell, H. (1828). "On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed". Philosophical Transactions 118 (365–71): 365. DOI:10.1098/rstl.1828.0021.
- ^ Robert Siegel. "Ethanol, Once Bypassed, Now Surging Ahead", NPR, 2007-02-15. Diakses pada 22 September 2007.
- ^ Joseph DiPardo. Outlook for Biomass Ethanol Production and Demand. (PDF) United States Department of Energy. Diakses pada 22 September 2007
- ^ a b c CRC Handbook of Chemistry, 44th ed.
- ^ a b c d Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (edisi ke-9th). Rahway, N.J., U.S.A: Merck. ISBN 0-911910-26-3.
- ^ "Encyclopedia of chemical technology". 9. (1991). 813.
- ^ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). "The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing". Aust J Chem. 33 (10): 2103–19. DOI:10.1071/CH9802103.
- ^ Lei Z, Wang H, Zhou R, Duan Z (2002). "Influence of salt added to solvent on extractive distillation". Chem Eng J. 87: 149–56. DOI:10.1016/S1385-8947(01)00211-X.
- ^ Pemberton RC, Mash CJ (September 1978). "Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 to 363.15 K determined by an accurate static method". J Chem Thermodyn. 10 (9): 867–88. DOI:10.1016/0021-9614(78)90160-X.
- ^ Merck Index of Chemicals and Drugs, 9th ed.; monographs 6575 through 6669
- ^ Kesalahan pengutipan: Tag
<ref> tidak sah; tidak ditemukan teks untuk ref bernama m_and_b
- ^ a b c d e f Streitweiser, Andrew Jr.; Heathcock, Clayton H. (1976). Introduction to Organic Chemistry. MacMillan. ISBN 0-02-418010-6.
- ^ Frederick D. Rossini (1937). "Heats of Formation of Simple Organic Molecules". Ind. Eng. Chem. 29 (12): 1424–1430. DOI:10.1021/ie50336a024.
- ^ Mills, G.A.; Ecklund, E.E. "Mills GA, Ecklund EE (1987). "Alcohols as Components of Transportation Fuels". Annual Review of Energy 12: 47–80. DOI:10.1146/annurev.eg.12.110187.000403.
- ^ Roberts, John D.; Caserio, Marjorie C. (1977). Basic Principles of Organic Chemistry. W. A. Benjamin, Inc. ISBN 0-8053-8329-8.
- ^ "Encyclopedia of chemical technology". 9. (1991). 82-.
- ^ Lodgsdon, J.E. (1994). p. 817
- ^ Morais PB, Rosa CA, Linardi VR, Carazza F, Nonato EA (November 1996). "Production of fuel alcohol by Saccharomyces strains from tropical habitats". Biotechnology Letters 18 (11): 1351–6. DOI:10.1007/BF00129969.
- ^ Badger, P.C. "Ethanol From Cellulose: A General Review." p. 17–21. In: J. Janick and A. Whipkey (eds.), Trends in new crops and new uses. ASHS Press, 2002, Alexandria, VA. Retrieved on September 2, 2007.